研究概要
概要
多細胞生物は、外界からのシグナルを受け取り、シグナル伝達機構、転写因子の活性化を通じて、種々の生物学的機能を発揮します。当研究室では、哺乳類の免疫応答機構がどのようなシグナルで制御されているかを、抗原提示細胞、樹状細胞に焦点を当てて、分子、細胞、個体の種々のレベルで研究を展開しています。
研究内容
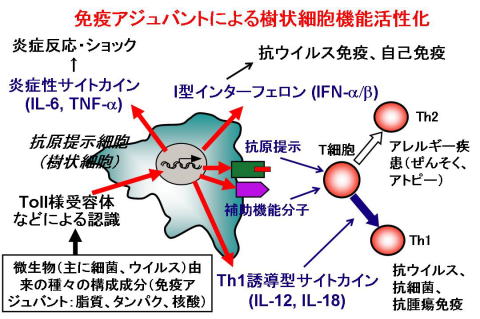
現在、研究室では、哺乳類の生体防御機構、特に、自然免疫と獲得免疫との協調作用を担う、樹状細胞に興味を持って研究を進めています。自然免疫は、ショウジョウバエから哺乳類まで保存されたシステムで、病原体を認識し、種々のサイトカインを産生することにより、病原体の迅速な排除に関与しています。また、T細胞の活性化、分化の方向付けをすることにより、獲得免疫の樹立にも必須の役割を果たしています。樹状細胞は、この一連の過程に必須の抗原提示細胞で、微生物由来の種々の成分(免疫アジュバント)を、Toll様受容体(TLR)を含む、種々の受容体を介して認識することにより機能します。この機構は感染や腫瘍に対する生体防御に必須ですが、バランスが崩れると、アレルギーや自己免疫など種々の病態も引き起こします。この機構を解明することにより、新たな免疫制御手段の獲得に結びつく成果が期待されます。我々は、種々の免疫アジュバント、遺伝子改変マウスを用いて、樹状細胞活性化機構に関与する機能分子を明らかにし、免疫応答を制御する手段の獲得を目指しています。
自然免疫と獲得免疫
ほ乳類などの高等動物は、生体防御機構として、自然免疫と獲得免疫の2つの柱を持っています。獲得免疫は、T細胞、B細胞などいわゆるリンパ球により担われていて、これらの細胞は、外来微生物由来の種々の抗原を、多様なレパートリーを持つT細胞受容体や免疫グロブリンにより認識します。獲得免疫は、抗原を高い親和性で特異的に認識することが可能で、また、抗原特異的な細胞を長期間保持できる記憶というシステムを保持しています。 しかし、獲得免疫の確立には時間を要し、迅速な応答機構は、主に自然免疫に依存しています。自然免疫は、主に食細胞(マクロファージ)、樹状細胞などいわゆる抗原提示細胞に担われています。これらの細胞は、病原微生物由来の種々の成分を病原体センサーと呼ばれる一群のタンパクにより認識します。病原体センサーは、リンパ球の受容体ほど多様なレパートリーを持っていませんが、いくつかのグループに属する病原体に共通した分子構造を認識することにより、種々の病原体感染に応答することができます。 病原体センサーを介して活性化された抗原提示細胞は、炎症性サイトカインやI型インターフェロン(IFN)などの液性因子を産生したり、また共刺激分子と呼ばれる膜タンパクの発現を増強します。そして、炎症反応を誘導したり、T細胞を中心とした獲得免疫機構を確立させたりします。
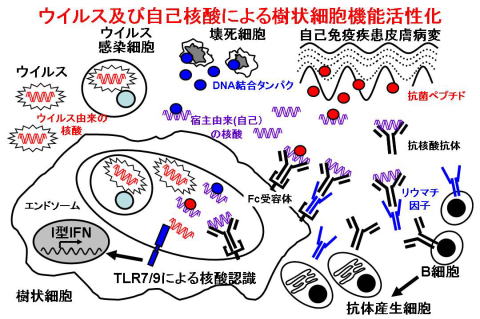
核酸刺激樹状細胞におけるI型インターフェロン産生制御機構
TLRs are able to recognize a variety of immune adjuvants. These adjuvants can be categorized into lipids, proteins, and nucleic acids according to their molecular characteristics. TLRs are able to transduce common immunostimulatory signals, but each TLR is also able to exhibit its own function. We are attempting to clarify how TLRs exert their pleiotropic functions, especially on DCs. Notably, nucleic acid adjuvants are featured by their ability to induce type I interferons(IFNs), especially IFN-alpha. Single stranded RNA (ssRNA) and CpG DNA function as the ligands for TLR7 and TLR9, respectively. TLR7- and TLR9-induced IFN-alpha production depends on a DC subset, called as plasmacytoid dendritic cells (PDCs) (Fig.1). PDC can be distinguished from conventional DC (cDC) according to the surface molecule expression. PDC expresses only TLR7 and TLR9 among TLRs and, by sensing virus-derived nucleic acids, plays vital roles in antiviral immunity as a type I IFN producing cell. Nucleic acid-induced type I IFN production also contributes to the pathogenesis of autoimmune disorders such as systemic lupus erythematosus (SLE). In those patients, anti-nucleic acid Abs are generated and form complexes with host-derived nucleic acids. Those complexes can induce type I IFNs. Indeed, in the patients, serum type I IFN levels are elevated and the elevation is correlated with the severity of the diseases. All TLR7/9-mediated effects, inlcluding induction of both inflammatory cytokines and type I IFNs, are dependent on a TLR-associated cytoplasmic adapter, MyD88. Downstream of MyD88, the signaling pathway is bifurcated into two pathways for inflammatory cytokine and type I IFN induction. The former pathway depends on NF-kappaB and the latter pathway, specific for PDC, requires a transcription factor, IRF-7. We have identified IKKalpha as a critical kinase selectively involved in this We have identified IKKalpha as a critical kinase selectively involved in this PDC-specific pathway (Fig.2). In IKKalpha-deficient mice, ability of PDC to produce IFN-alpha in response to TLR7/9 signaling is severely impaired. However, TLR7/9-induced production of inflammatory cytokines is mildly or marginally impaired. IKKalpha can associate with and phosphorylate IRF-7, thereby activating IRF-7 function. IKKalpha should be a candidate target molecule for treating autoimmune disorders.











